Същността на периодичната таблица - химия за Манекени от нулата, основите на химията, himi4ka
Дори и в училище, седи в уроците по химия, всички си спомняме маса на стената на един клас или химическа лаборатория. Тази таблица съдържа класификация на всички известни химични елементи на човечеството, основните елементи, които изграждат Земята и цялата вселена. Тогава не можех да мисля, че периодичната таблица е несъмнено една от най-голямото научно откритие, което е в основата на съвременната ни познания по химия.
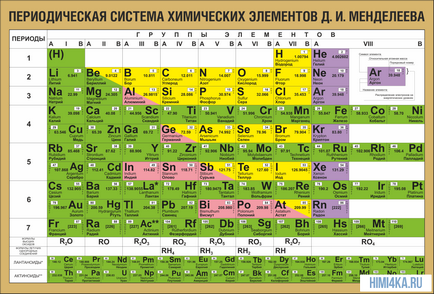
На пръв поглед идеята й е измамно прост: да организира елементи в реда на нарастване на теглото на техните атоми. Освен това, в повечето случаи се оказва, че химични и физични свойства на всеки елемент са сходни с предишния елемент в масата си. Този модел е очевидно за всички елементи, с изключение на няколко първи, просто защото те не разполагат пред елементи, подобни на тяхното атомно тегло. Това е благодарение на откриването на такъв имот можем да сложим линейна последователност на елементите в таблицата, е много подобен на календара на стената, и по този начин да се съчетаят и огромно разнообразие от химични елементи в ясна и последователна форма. Разбира се, днес ние използваме концепцията за атомния номер (брой протони), с цел да се рационализира елементите на системата. Това помогна за решаване на така наречените технически проблем ", чифт пермутации", която обаче не доведе до фундаментална промяна във формата на периодичната таблица.
Във всички елементи на периодичната таблица са подредени в съответствие с техния атомен номер, електронна конфигурация и повтарящи химични свойства. Редове в таблицата, се наричат периоди и колони групи. В първата таблица, датираща от 1869 година, който съдържа общо 60 елемента, сега на масата трябва да бъде увеличен до 118 изведе елементи, известни на нас днес.

Свойствата на периодичната таблица
В периодичната таблица организира не само елементи, но също и голямо разнообразие от имоти. Химик е достатъчно често, за да имаме пред очите ми на периодичната таблица, с цел да се отговори правилно на много въпроси (а не само на изпита, но и научно).

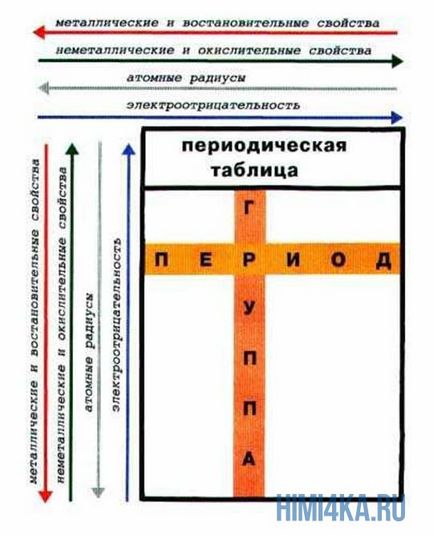
Нека да погледнем отново в периодичната таблица. В допълнение към дълбоката фундаментална връзка между елементите, тя отразява редица полезни за изучаване на законите на химията.
Периоди - хоризонталните линии на химичните елементи.
Групи - вертикални колони на химичните елементи.
Подгрупа - А - основна (S-и р-компоненти) и в страната - (D- и F-елементи).
период номер - на нивото на външна енергия в електронния елемент към формула атом.
номер група (за повечето елементи) - общият брой на валентните електрони (електрони от външния слой, както и предпоследния ред г-ако не е изградена изцяло).
Броят на елементите в периода - максималният капацитет на съответното ниво на енергия:
1 цикъл - 2 елементи (1S 2)
Период 2 - 8 елементи (2s 2 2p 6)
Период 3 - 8 елементи (3s 3P 2, 6)
4 период - 18 елементи (4S 2 4P 10 6 3D)
Между 5-18 елементи (5s 5р 2 10 4d 6)
6 период - 32 елемента (6S 2 4f 14 10 5d 6p 6)
7 период не са завършили -
Периодът на строителство - началото: два S-елемент, в края на шест р-елементи. В четвъртата и петата периоди между пристъпи на десет г-елементи, и в шестата и седмата добавени към тях четиринадесет F-елементи (форми на електрони орбитали).
Периодът - свойства на химичните елементи се различават един от друг, от електронната конфигурация на валентните електрони атоми различни.
В подгрупа - свойства на елементите, подобни на един друг, тъй като електронната конфигурация на валентните електрони атоми са сходни. Причината за периодичността на свойствата на химическите елементи в периодичната повтарянето на подобни електронни конфигурации на външни енергийни нива.
Класификацията на химични елементи в ИМОТИ
Алкални и алкалоземни
Те включват елементи на първата и втората група на периодичната таблица. Алкалните метали от първата група - лек метал, сребро, добре нарязани с нож. Всички те имат една единствена електрон във външната обвивка и перфектно реагира. Алкалоземни метали от втората група имат цвят сребро. Външно поставени два електрона, и съответно тези метали са по-малко вероятно да взаимодействат с други елементи. В сравнение с алкални метали, алкалоземни метали се стопяват и се вари при по-високи температури.