Salt Уикипедия - Уикипедия соли карта - Информация от Wikipedia на картата, gulliway
Соли - комплексни вещества, които се разпадат в метални катиони и аниони на анионите във водни разтвори. IUPAC определя сол като химични съединения, съставени от катиони и аниони. Има и друго определение: соли са вещества, които могат да бъдат получени чрез взаимодействие на киселина и основа с отстраняване на вода.
Освен това металните катиони в солите могат да бъдат амониеви катиони NH4. .. PH4 фосфониеви производни и техните органични и комплексни катиони, и т.н. Аниони на соли са анионите в киселина остатъчни различни Йоханес Брьонстед киселини - от неорганичен както и органични аниони, включително комплекс и карбанйоните.
М. В. Ломоносов в неговите произведения по химия и физика, описан понятието "сол":
име соли посочи чуплива орган, който се разтваря във вода и остава ясна; те не светне, ако чистите изложения на огън. Тяхната видове: сярна киселина и всяка друга метална сол, стипца, боракс, зъбен камък, значително сол растения, сол, сметана на зъбен камък и поташ, лети пикочна сол, селитра, готварска сол пролетта, морски и каменни, миришещи соли, английска сол и други соли, получени в резултат на химични работи.
видове сол
Ако разгледаме сол като протонен заместващи продукти с киселини или основи в gidroksogrupp, можем да се разграничат следните видове соли:
- Средните (нормални) сол - заместване продукти от водородни катиони при киселинни молекули на метални катиони (Na2 CO3 K3 РО4.).
- Киселинните соли - продукти на частично заместване на катиона водород в киселините на метални катиони (NaHCO3 К2 НРО 4.). Те се образуват чрез неутрализиране на киселината с излишък от основа (т.е., в липса на основа или излишък киселина).
- Основни соли - заместване продукти от непълно gidroksogrupp база (ОН) киселинни остатъци ((CuOH) 2 CO3). Те се образуват при условията на излишък от основа или киселина дефицит.
Съгласно настоящото брой в структурата на катионите и анионите на следните видове соли:
- Обикновено соли - сол, състояща се от един вид на катиони и един вид на анион (NaCl)
- Двойните соли - соли с два различни катиони (Kal (SO4) 2 · 12 Н 2О).
- Смесени соли - соли, в която структура е налице две различни анион (Са (OCl) Cl).
Също така се прави разлика хидратни соли (кристален хидрат), които включват молекули кристализационна вода, например, Na 2SO 4 · 10 Н 2О и комплексни соли. съдържащ комплекс катион или анион комплекс (К4 [Fe (CN) 6], [Cu (NH3) 4] (ОН) 2). Вътрешни соли се образуват с биполярни йони, т.е. молекули, които съдържат както положително заредена и отрицателно зареден атом.
номенклатура соли
Номенклатура окислен соли
Имена соли обикновено са свързани с имената на съответните киселини. Тъй като много киселини по български език са тривиални или традиционни имена, подобни имена (нитрати, фосфати, карбонати, и т.н.) също се съхраняват и соли.
Традиционните имена на соли, съставени от имена аниони в поименно случай и имената на катиони в родителен случай. Имена на аниони са базирани на български или латинските наименования на киселинни елементи. Ако елемент киселина образуващ може да има една степен на окисление, се добавя към името наставка -в:
CO3 - карбонат, GEO3 - germanate.
Ако киселина образуващ елемент може да две окисление, след анион, образуван в този елемент в по-висока степен на окисление, използвани -в наставка. и за анион с елементи в по-малка степен на окисление - наставка -um на:
Ако елементът има три окисление, се използват за горната, средната и ниската степен на окисление, съответно наставки -в. и суфикса -um -um с хипо префикс -:
Накрая, в случай на елементи, като четири окисление за висока окисляване префикс използва писалка - и наставка -в. по-долу (в ред на намаляване на окисление) наставка -в. наставка и наставка -um -um с хипо префикс -:
СЮ4 - перхлорат, ClO3 - хлорат, ClO2 - хлорит, СЮ - хипохлорид.
Представки мета -, орто -, поли -, ди -, три -, пероксо - .., и т.н. са традиционно присъства в имената на киселини, също се съхраняват в имената на аниони.
Имена Имена катиони съответстват на елементите, от които те се получават: ако е подходящо определен брой атоми в катиона (Dirtuti (2+ катион) HG2 катион tetramyshyaka (2+) AS4.) И степента на окисление, ако е променлива.
Имена киселинни соли, получени чрез добавяне на префикс хидро - дял анион. Ако един анион има повече от един водороден атом, сумата, посочена чрез умножаване конзоли (NaHCO3 - натриев бикарбонат, NaH2 РО4 - натриев дихидроген фосфат). По същия начин, за да образуват основни соли наименования, използвани префикси хидроксо - ((FeOH) NO3 - gidroksonitrat желязо (II)).
Кристален хидрат дава името чрез добавяне на думата на стандартен хидрат или сол систематичен името (Pb (BrO3) 2 · Н2 О - хидрат олово бромат (II), Na2 CO3 · 10 Н 2О - натриев карбонат декахидрат). Ако известна кристална структура, номенклатурата могат да се използват комплексни съединения ([Be (Н 2О) 4] SO4 - сулфат tetraakvaberilliya (II)).
За някои класове соли съществуващите име група, например, стипца - за двоен общ тип MM сулфати (SO4) 2 · 12 Н 2О, където М - катиони на натрий, калий, рубидий, цезий, талий, или амониев, и М - алуминиеви катиони, галий , индий, талий, титан, ванадий, хром, манган, желязо, кобалт, родий или иридий.
За използват по-сложни или редки соли системни имена са образувани в съответствие с правилата на номенклатурата на комплексни съединения. Съгласно тази номенклатура, солта е разделена на външна и вътрешна сфера (катион и анион): последният се състои от централен атом и лиганди - атома свързан към централния атом. Заглавие сол се образува както следва. Първоначално записани име вътрешната сфера (анион) в поименно случай, състояща се от лиганди имена (префикси) и централен елемент (корен) -в наставка и показва степен на окисление. След това се добавят името на името на външната областта на атомите (катиони) в родителен случай.
LiBO3 - trioksoborat (III) литиев Na2 CR2 О7 - geptaoksodihromat (VI) NaHSO4 натриев - tetraoksosulfat (VI) -натриев водород
Номенклатура соли аноксични киселина
За образуване на соли аноксични имена са общи имена компилация правила двоични съединения: прилага универсално правила номенклатура определящи числови префикси или стволови показващи степента на окисление, като се предпочита втория метод.
Имена халогениди се получават от името халоген наставка -id и катион (NaBr - натриев бромид, SF6 - серен флуорид (VI), или серен хексафлуорид, Nb6 I11 - undekaiodid geksaniobiya). Освен това, има pseudohalide класа - соли, които съдържат аниони с galogenidopodobnymi свойства. Техните имена са оформени по подобен начин (Fe (CN) 2 - цианид, желязо (II), AgNCS - тиоцианат, сребърен (I)).
Chalcogenides. съдържащ като анион сяра, селен и телур, наречен сулфиди, селениди и телуриди. Сероводород и селенид могат да образуват присъединителни с киселина соли, които се наричат съответно gidroselenidami хидросулфид и (ZnS - цинков сулфид, SiS2 - силициев дисулфидни, NaHS - натриев хидросулфид). Двойни сулфиди наречени сочи две катион смесен: (FeCu) S2 - дисулфид, мед желязо.
Физичните свойства и структурата на соли
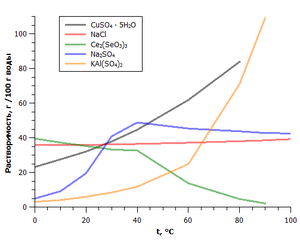
Зависимостта на разтворимостта на някои соли на температурата
Обикновено, солите са кристални вещества с йон кристална решетка. Например, кристалите на халогениди на алкални и алкалоземни метали (NaCl, CsCl, CaF2), конструирани на аниони, разположени на принципа на най-плътната сферична опаковка, и катиони, заемащи кухини в опаковката. Йонни кристали на соли могат също да бъдат конструирани от киселинни остатъци комбинирани в безкрайни анионни групи и триизмерни скелета с катиони в кухините (силикати). Тази структура подходящо отразени в техните физични свойства: те имат високи точки на топене, в твърдо състояние са изолатори.
Също така известно молекулно (ковалентна) сол структура (например, алуминиев хлорид AlCl3). Много соли на природата на химическите връзки е междинно между йонно и ковалентно.
От особен интерес са йонни течности - соли с точка на топене под 100 ° С Освен това ненормално температура на топене йонни течности са практически нула парното налягане и висок вискозитет. Специалните свойства на тези соли са обяснени с ниска симетрия катион, слабо взаимодействие между йони и добро разпределяне на шихтата катион.
Важно свойство на солите е тяхната разтворимост във вода. По този критерий секретират разтворими, умерено разтворими и неразтворими соли.
Да бъдеш в природата
методи за получаване
Има различни методи за получаване на соли:
- Взаимодействие киселини с метали, основни и амфотерни оксиди / хидроксиди:
Н2 S O 4 + М грама ⟶ М г S O 4 + Н 2 ↑ + Mg \ longrightarrow MgSO_ \ uparrow >>>
Н2 S O 4 + М грама О ⟶ М г S O 4 + Н 2О + MgO \ longrightarrow MgSO_O >>>
3 H 2 O S 4 + A л 2O 3 ⟶ А л 2 (S О 4) 3 + 3 Н 2О + Al_ \ longrightarrow Al _) _ О >>>
- Взаимодействие на кисели окиси в основи, основни и амфотерни оксиди / хидроксиди:
С един О + S и О 2 ⟶ С на S и О 3 \ longrightarrow CASIO _ >>
А л 2O 3 + 3 S O 3 ⟶ А л 2 (S О 4) 3 \ longrightarrow Al _) _ >>
- Взаимодействие в киселини соли, други соли (образувани при излизане от реакционния продукт):
C С О 3 + 2 H С л ⟶ C С л 2 + Н 2О + C O 2 ↑ + 2HCl \ longrightarrow CaCl_O + Co_ \ uparrow >>>
С ф С л 2 2 + N а S ⟶ 2 N С л + C U S ↓ + Na_S \ longrightarrow 2NaCl + CuS \ стрелка надолу докато стигнете >>>
- Взаимодействието на прости вещества:
- Взаимодействие с бази неметали, например, с халогени:
С а (О Н) + 2 ° С л 2 ⟶ С а (О С л) С л + Н 2О + Cl_ \ longrightarrow Са (OCl) Cl + Н _ >>
Кристални хидрати обикновено се получават чрез кристализация на соли от водни разтвори, но също така известни кристални солвати соли, падащи от неводни разтворители (например, CaBr2 · 3 С2 Н5 ОН).
химични свойства
Химичните свойства се определят от свойствата на катиони и аниони в тях.
Соли реагират с киселини и основи, ако се получава реакционен продукт, който излиза от реакция (утайка газ malodissotsiiruyuschie вещество като вода) на:
B С л 2 + H 2 O S 4 ⟶ Б а S O 4 ↓ + 2Н С л \ longrightarrow BaSO_ \ стрелка надолу докато стигнете + 2HCl >>>
N Н С О 3 + Н С л ⟶ N С л + Н 2О + C O 2 ↑ + HCl \ longrightarrow NaCl + H_ \ uparrow >>>
N 2 S и О 2 + 3 Н С л ⟶ 2 N С л + H 2 S и О 3 ↓ SiO_ + 2HCl \ longrightarrow 2NaCl + H_SiO_ \ стрелка надолу докато стигнете >>>
Соли реагират с метали, ако металът е оставен свободен от метални соли, състоящи се от метали в електрохимична серия активност:
С ф + Н грама С л 2 ⟶ С ф С л 2 + Н гр \ longrightarrow CuCl _ >>
Соли взаимодействат един с друг, ако реакционният продукт излиза от реакционната зона (газ Образуваната утайка или водата); включително тези реакции могат да се проведе с степени на окисление реактиви атома промени:
C С л 2 N + 2 ° С О 3 ⟶ C С О 3 ↓ + 2 N С л + Na_ \ longrightarrow CaCO_ \ стрелка надолу докато стигнете + 2NaCl >>>
А г Н О 3 + N С л ⟶ А г С л ↓ + N на N О 3 + NaCl \ longrightarrow AgCl \ стрелка надолу докато стигнете + NaNO _ >>
К 2 C R 2О 7 + 3 N 2 SO 3 + 4 H 2 SO 4 ⟶ C R 2 (SO 4) 3 + 3 N 2 SO 4 + K 2 SO 4 + 4 Н 2О + 3Na_ + K_ + 4Н _ >>
Някои соли разлагат при нагряване:
С ф C O 3 ⟶ С ф О + C O 2 ↑ \ longrightarrow CuO + Co_ \ uparrow >>>
4 N Н N О 3 ⟶ N 2 O ↑ + 2 H 2 O \ longrightarrow N_O \ uparrow + 2Н _ >>
4 N Н N О 2 ⟶ N 2 ↑ + 2 H 2 O \ longrightarrow N_ \ uparrow + 2Н _ >>
Дисоциация във водни разтвори
напълно или частично дисоциират на йони при разтваряне в солена вода. Ако дисоциация се случва равномерно, солите са силни електролити, или - слаби. Един пример на типичен силни електролити могат да бъдат соли на алкални метали, които съществуват в солватирани йони в разтвор. Въпреки факта, че широко разпространената теория, която твърди, че солите дисоциират във воден разтвор напълно, в действителност за повечето соли, има частично разпадане, например, 0,1 М FeCl3 разтвор съдържа само 10% от катиони на Fe и 42% от катионите FeCl, 40% от катионите FeCl2. Катиони FeOH 6% и 2% от катионите Fe (ОН) 2.
соли Хидролиза
Някои соли във воден разтвор са способни да претърпява хидролиза. Тази реакция е обратимо за соли на слаби киселини (Na2 CO3), или слаби основи (CuCl 2), и необратимо - за соли на слаби киселини и слаби основи (Al2 S3).