Периодичната таблица на елементите
Периодична система на химичните елементи (периодичната таблица) - класификация на химичните елементи. за създаване на зависимост на различни свойства на елементите от заряда на атомното ядро. Системата е графичен израз на периодичния закон. създадена български химик Г. И. Mendeleevym през 1869. Първоначалната му версия е разработена Г. И. Mendeleevym в годините 1869-1871 и установена зависимостта на свойствата на елементи от техния атомно тегло (по модерен начин, от атомната маса). Общо предложени няколко стотици [1] изображението на периодични изпълнения системата (аналитични криви, таблици, геометрични фигури и така нататък. П.). В настоящото изпълнение, системата поема елементи намаляването на двуизмерен таблица, в която всяка колона (група) определя основните физични и химични свойства, и редовете представляват периоди. до известна степен подобни един на друг.

Според легендата, идеята за химическите елементи на системата дойде на Менделеев в съня си, но ние знаем, че след като въпросът за това как той открива периодичната система, ученият каза: "Аз съм над него, може би двадесет години мисъл, и си мислиш: дневна и изведнъж ... готов. "
Писане на карти основни свойства на всеки елемент (който по това време е бил известен до 63, от които един - Дидим Ди - Оказа се, в бъдеще със смес от празеодим две новооткрити елементи и неодим), Менделеев започва да многократно реорганизиране на тези карти, да направи една поредица от подобни свойства елементи съответстват на серия помежду [3]. Работата е изпратен през 1869 г. до академичните институции в България и други страни, първата версия на системата ( "Опитът на елементите, въз основа на тяхното атомно тегло и химическа прилика"), в която елементите са били пуснати на деветнадесет хоризонтални редове (редове от подобни елементи, които са станали прототипите групи на съвременната система) и шест вертикални колони (прототип на бъдещи периоди). През 1870 godu Менделеев в "Основи на Chemistry", публикувана версия на втората система ( "естествен система на елементите"), имащи вид познат ни: хоризонтални колони аналогови елементи превърнати в осем групи от вертикално подредени; шест вертикални колони се превръща в първото изпълнение в периоди, започващи и завършващи с халоген алкален метал. Всеки период се разделя на две серии; различни елементи, включени в групата, образувана от серия подгрупи.

Корица на брошурата "Опитвайки се да разбере химическата свят ефира" и периодичната таблица на елементите от нея (политехнически музей, Москва, 1902 издание)
Същността на откритието на Менделеев е фактът, че с увеличаване на атомно тегло на химически елементи от техните свойства не се променят монотонно, но от време на време. След определен брой различни свойства на елементи, подредени в увеличаване атомно тегло, свойствата започват да се повтори. Например, натриев е подобен на калий. подобен на флуоро хлоро. и злато като сребро и мед. Разбира се, имотите не се повтарят точно, се добавят към тях и да се промени. С участието на работата на работа на Менделеев от неговите предшественици е, че основите на класификацията на елементите Менделеев не е една, а две - атомно тегло и химическа прилика. За да периодичност на пълното спазване на Менделеев е било взето много смели стъпки той коригира атомните тегла на някои елементи (например, берилий, индий уран торий, церий титан итрий ......), няколко вида стоки, публикувани във вашата система противоречи на приема, докато представяния на тяхното сходство с друга (например, талий. се счита алкален метал, се поставя в третата група съгласно действителната максимална валентност), оставя празни клетки в таблицата, където те би трябвало да остане отворен докато елементите , През 1871 г., въз основа на тази работа Менделеев формулира периодичния закон. което в крайна сметка форма е малко се подобри.
Научната точността на периодичния закон бе потвърдено в най-скоро: през 1875 -1886 година са открити галий (ека-алуминий), скандий (ekabor) и германий (ekasilitsy), за които Менделеев, като се възползва от периодичната система, прогнозира не само възможността за тяхното съществуване, но и с поразителна точност описва редица физични и химични свойства.
В началото на XX век, беше установено, че честотни свойства се променят елементи се определя не атомно тегло, и ядрен заряд отваряне атомна структура. равна на атомния номер и броя на електроните, които са разпределени по електронен слой атоми елемент определя неговите химични свойства.
Елементи 115 и 117 са получили името на Московия (Mc) и tennessin (Ts) в съответствие с предложенията на ОИЯИ и Oak Ridge National Laboratory, Vanderbilt University и Националната лаборатория Лоурънс Ливърмор в САЩ.
Най-разпространени са 3 форми на периодичната таблица, "къси" (краткосрочен период), "дълги" (в дългосрочен период) и "супер-дълго." В "Ultra Long" версия на всеки период отнема точно един ред. "Дълга" изпълнение лантаниди и актиниди отстраняват от общата маса, което го прави по-компактен. В "кратко" под формата на записа, в допълнение към това, четвърти и следващите периоди, заети от 2 линии; символи на елементите на основните и подгрупи на ръбове се подравняват по отношение на различни клетки. Водородът се понякога поставя в 7-ма ( "къса" форма) или 17-ти ( "дълга" форма) маса група [5] [6].
По-долу е по-дълъг вариант (в дългосрочен период форма), одобрен от Международния съюз за чиста и приложна химия (IUPAC) като ядро.
Периодичната таблица на елементите
Кратката форма на таблицата. съдържащ осем групи от елементи [7]. IUPAC официално премахнато през 1989 година. Въпреки препоръката да се използва пълната форма, кратка форма продължава да се движи по голяма част от българските наръчници и ръководства, а след този час. От съвременна чуждестранна литература кратка форма се изключва напълно, вместо да го използва пълната форма. Ситуация някои изследователи сочат, включително очевидно рационално компактност на кратката форма на масата, както и инерцията, стереотипно мислене и не-възприятие на съвременния (международен) информация [8].
През 1970 г. Теодор Siborg предложи удължения периодичната таблица. Niels Бор разработен стълба (пирамидална) форма на периодичната система. Има много други, по-рядко или не се използва, а по-скоро на оригинала, начини за графично показване на Закона Периодична [9] [10]. Днес има стотици варианти за масата, учените предполагат, всички нови опции. [11]
Разрешение групи
Група или семейство - една от колоните на периодичната таблица. За групи обикновено се характеризират с по същество периодично тенденция изразен отколкото за периоди или блокове. Modern квантово-механична теория на атомната структура обясни група сходство с това, че елементите в рамките на една и съща група обикновено имат подобни електронни конфигурации в техните валентните черупки. [12] Съответно, елементите, които принадлежат към същата група традиционно имат сходни химични свойства и показват ясно модел на промяна в свойствата с увеличаване атомен номер [13]. Въпреки това, в някои области на масата, например - в г блок и е блок хоризонтална сходство може да бъде също толкова важно, или още по-значително експресиран от вертикален [14] [15] [16].
В съответствие с международната система на именуване групи са номерирани от 1 до 18 от ляво на дясно - от алкален метал на благороден газ [17]. По-рано, на тяхната идентификация се използва римски цифри. На практика, след американските римски цифри, свързани както буква А (ако групата намира в S-р-блок или блок) или В (ако една група е в D-блок). След това се прилага идентификатори съответстват на последната цифра от съвременни числени показатели - например, елементи от групата 4 съответства на името на IVB, и тези, които сега са известни като група от 14 - IVA. Подобна система е била използвана в Европа, с изключение на това, че буквата А се отнася до групата до десетия, а в - групи от десетия включително. Групи 8, 9 и 10, освен това, често се разглеждат като една тройна идентификатор група VIII. През 1988 г. влезе в сила нова система за означаване на IUPAC. и бивши имена на групи от употреба [18].
Някои от тези групи са възложени на тривиално, несистемно името (например, "алкалоземни метали", "халоген" и др ...); Въпреки това, някои от тях са рядко използвани. Групи три през четиринадесети, включително, тези имена не са, и те са идентифицирани или като брой, или по име на първия потребител ( "титан", "кобалт" и т.н.), тъй като те показват по-ниска степен на сходство помежду си или с минимален съответствие вертикална закономерности [17].
Елементи, принадлежащи към същата група са склонни да показват някои тенденции в атомен радиус. йонизационна енергия и Електроотрицателност. От горе до долу в радиус увеличава група атом (колкото повече пълни енергийни нива, по-нататъшното от ядрото са разположени валентните електрони) и йонизационна енергия намалява (в атома отслабва, и следователно, се оттегли електрон става по-лесно), както и и електроотрицателност (който от своя страна причинява увеличаване на разстоянието между електроните валентните и ядрото) [19]. Случи, обаче, са изключения от тези модели - например в групата 11 в посока надолу електроотрицателност увеличава и не намалява [20].
периоди Редактиране
Период - ред на периодичната таблица. Въпреки, че групите, както е споменато по-горе, се характеризира с по-значителни тенденции и модели, има също така регион, където хоризонтална посока е по-голямо и значимо от вертикална - например, това се отнася до F-блок, където лантанидите и актинидите образуват две важни елементи хоризонтална последователности [ 21].
В периода на елементите проявяват някои закономерности в трите гореспоменатите аспекти (атомен радиус, Електроотрицателност и йонизационна енергия) и енергията на електрон афинитет. От ляво на дясно атомен радиус обикновено намалява (поради факта, че всеки следващ елемент увеличава броя на заредените частици и електрони са привлечени близо до ядрото [22]) и йонизационна енергия се увеличава паралелно с тях (силна връзката с атома, още по- енергия се изисква за електронно теглене). Подходящо увеличаване Електроотрицателност и [19]. Що се отнася до електрон афинитет металите в лявата част на таблицата се характеризират с по-ниска стойност на този индекс, и в правилните неметали съответно големи - с изключение на благородни газове [23].
блокове Редактиране
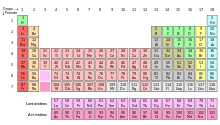
Диаграмата на блок на Периодичната таблица
С оглед на важността на външната обвивка електрон различните области на Периодичната таблица атом понякога се описва като блокове, посочена в съответствие с реда, при която черупката е последната електрона [24]. S-блок включва първите две групи. т.е. на алкални и алкалоземни метали, както и водород и хелий; р-блок се състои от последните шест групи (13 до 18 по стандарта IUPAC именуване, или IIIA до VIIIA на американската система) и включва, наред с други елементи, всички металоиди. D-блок - група с 3 до 12 (IUPAC), те - IIIB да IIb с американски, които включват всички преходни метали. F-блок. поносим обикновено извън масата, състояща се от лантаниди и актиниди. [25]
Други периодични колебания Редактиране
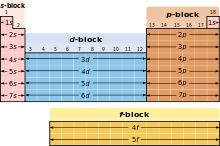
Приблизителна стойност на поръчката в съответствие с член Madelung.
Отделно от горното, периодичен закон и в съответствие с някои други характеристики на елементите:
- Електронна конфигурация. електрони организация демонстрира определено периодично повтарящ се модел. Електроните заемат черупки последователности, които са идентифицирани от номера (1 обвивка, обвивката 2 и т. Г.), както и тези от своя страна се състои от поднива, определени от буквите S, Р, D, F и ж. Както атомния номер на електрони постепенно запълване на корпуса; всеки път, когато електрон се нов корпус за първи път, нов период започва в таблицата. Прилики в електронен конфигурация определяне подобие на свойствата на елементи (наблюдението, че в действителност, са довели до откриването на периодичната практика) [26] [27].
- Metallicity / nemetallichnost. Чрез намаляване показатели йонизационна енергия електроотрицателност и електронно сродство енергийни елементи придобиват характеристиките на метал, и тъй като те увеличават - напротив, за неметали [28]. В съответствие със законите за посочените по-горе характеристики, най-ясно изразени метали са разположени в ранен период и неметали - в края му. В групите, от друга страна, като един се движи от горе до долу метални свойства се увеличават, макар и с някои изключения от общото правило. Комбинацията от хоризонтални и вертикални модели дава условно разделителна линия между метали и неметали пристъпи форма; по тази линия елементи понякога са определени като металоиди [29] [30].

Свойства на елементи. Стрелките показват увеличава.
Периодичната таблица на DI Менделеев е етап в развитието на теорията атомен молекулно. Благодарение на това, модерна концепция на химичния елемент. Беше рафинирани понятия прости вещества и съединения.
На предсказуем ролята на периодичната система, както е показано от по-Менделеев, в XX век се яви в оценката на химичните свойства на трансуранови елементи.
Разработен в XIX век. в рамките на науката за химия. периодичната таблица е завършен подреждане на видове атоми за нови клонове на физиката. са се развили в началото на XX век. - физика на атома и ядрената физика. В изследването на методи атом физика, беше установено, че серийният номер на елемента в периодичната таблица, наричана още редица елементи. (Атомен номер) е мярка на електрическия заряд на атомната сърцевината на този елемент, номерът на хоризонтален ред (период) в таблицата определя броя на електронен слой атоми. и броят на вертикалните редове - квантовата структура на горната обвивка, които са необходими елементи и тази серия сходство химични свойства.
Появата на периодичната система и откриването на периодичния закон откри нов, истински научен ера в историята на химията и редица свързани дисциплини - вместо разпръснати информация за елементите и съединения, Д. И. Mendeleevym и неговите последователи създават хармонична система, въз основа на която е станало възможно да се правят обобщения, се правят заключения, предвиди.