Изчисленията при получаването на водни разтвори на
Приблизителни решения. При приготвянето на разтвори на приблизителни количества от вещества, които трябва да се вземат за този, изчислен с малка точност. Атомните теглата на елементите за опростяване на право да понякога закръглена до цели единици изчисленията. По този начин, за грубо броенето атомното тегло на желязо може да се приема като 56 вместо точната -55.847; сяра - 32 вместо точната 32.064 и др ...
Веществата, за вземане на решения приблизителни или химико-технически претеглят на техническа баланс.
В основата изчисления за получаване на разтвори са идентични за всички вещества.
Количеството на разтвора се получава или е изразен в масови единици (г кг), или в единици за обем (мл, п), и за всеки от тези случаи, изчисляване на размера на разтвореното вещество се извършва по различен начин.
Пример. Да предположим, че е необходимо за получаване на 1,5 кг от 15% разтвор на натриев хлорид; предварително се изчисли необходимото Брой на включените-ТА сол. Изчислението се извършва в съответствие със съотношението:
т. е. когато 100 г разтвор съдържа 15 г сол (15%), колко е необходимо да се приготвя разтвор от 1500 г?
Изчислението показва, че е необходимо да се оценят на 225 грама сол, а след това да вземе вода iuzhio 1500-225 = 1275 |
Ако е зададено да се получи 1,5 литра същия разтвор, в този случай, директорията ще знаят нейната плътност се умножава в последния предварително определен обем и по този начин теглото се изисква количество разтвор. По този начин, плътността -noro 15% разтвор на натриев хлорид при 15 0 ° С равна на 1,184 гр / cm3. Така, 1500 мл
Следователно, количеството на веществото за получаване на 1,5 кг и 1,5 литра разтвор варира.
Изчисляването горе, е приложимо само за получаване на безводни разтвори на вещества. Ако вземете вода сол като Na2SO4-IOH2O1 изчислението се променя до известна степен, тъй като е необходимо да се вземат под внимание водата на кристализация.
Пример. Да предположим, че е необходимо да се получи 2 кг от 10% разтвор на Na2SO4, въз основа на Na2SO4 * 10Н2О.
Молекулното тегло е 142,041 Na2SO4, Na2SO4 * 10Н2О на 322,195, 322.20 или закръглени.
Изчисляване са първи па безводен сол:
Следователно е необходимо да се вземат 200 г безводна сол. Номер Декахидратът соли се намира от изчислението:
Тъй като разтворът не винаги получава с превръщане в безводната сол на етикета, което задължително трябва да се придържаме към съда с разтвора, е необходимо да се определи, от която сол разтвор се получава, например, 10% разтвор на Na2SO4 или 25% Na2SO4 на * 10Н2О.
Това често се случва, че предварително приготвен разтвор трябва да се разреди, т.е. да се намали концентрацията му ..; разредени разтвори или обемни или тегловни.
Сега можем да се изчисли колко да вземе 20% * раси създава, за да се получи 2 литра разтвор на 5%.
Полученият разтвор може да се разчита на теглото от обема си. Към този разтвор тегло, разделена на неговата плътност (плътност 20% разтвор е 1,1149 грама / cm3), т. Е.
Ако разреждането, извършено от теглото, изчисляването е опростена. Но като цяло, разреждане се извършва въз основа на обема, като течност, особено в големи количества, е по-лесно да се измери по отношение на обема от теглото.
Трябва да се помни, че при всяка работа като разпадането и разреждане не трябва да се изсипва наведнъж цялото количество вода в съда. Промива няколко пъти с вода ястия, които се провеждат претегляне или измерване на желаната субстанция, и всеки път, когато се добавя вода към разтвора на кораб.
Когато не изискват специални решения точност при разреждане или смесването им да се получат разтвори с различни концентрации могат да използват следния прост и бърз начин.
Вземете случая на вече анализирани разреждане на 20% разтвор на амониев сулфат до 5%. Писане в началото, както следва:
където 20 - разтвор взети концентрация 0 - вода и 5 '- изискваната концентрация. Сега ние се изважда 20 от 5 и пише стойността, получена в долния десен ъгъл на изваждане на нула от 5, пише цифра в горния десен ъгъл. След това схемата ще изглежда така:
Това означава, че е необходимо да се вземат 5 обема разтвор на 20% и 15 обема вода. Разбира се, това изчисление не се различава точност.
Ако два разтвора се смесват едно и също вещество, веригата продължава същото, промяна само числови стойности. Нека смесване 35% разтвор и 15% -ен необходимо за получаване на 25% разтвор. След това схемата ще изглежда така:
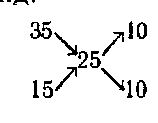
т. е. да се вземат до 10 обема от двата разтвора. Тази схема дава приблизителни резултати и може да се използва само когато специален точност не е trebuetsya.Dlya всеки химик е много важно да се култивира навика точност в изчисленията, когато е необходимо, и да използва приблизителни стойности в случаите, когато това не се отразява на резултатите raboty.Kogda трябва по-голяма точност в разреден разтвор, изчислението се извършва формули.
Нека разгледаме няколко важни случаи.
Получаване на разреден разтвор. Нека в - количество на разтвора, т% -концентрационно разтвор, който трябва да се разреди до концентрация от п%. Където полученият разреден разтвор количество х се изчислява по формулата:
и вода за разреждане обем V на разтвора се изчислява по формулата:
Смесването на двата разтвора на същите вещества в различни концентрации, за да се получи желаната концентрация на разтвор. Нека смесване части и т% разтвор с х части N% разтвор, необходимо за получаване /% - разтвор беше след това:
Точните разтвори. При приготвянето на разтвори, точното изчисление на контролни количества от желаните вещества имат достатъчна степен на точност. Атомни елементи баланс, взети от таблицата, която показва точните им стойности. При добавяне (или изваждане) са точни термин стойност с най-малък брой знака след десетичната запетая. Останалите условия са закръглени, оставяйки след десетичната запетая един знак повече в сравнение с термина с най-малък брой знаци. В резултат на това много от тях напускат знака след десетичната запетая, тъй като има в термина с най-малък брой знака след десетичната запетая; в същото време се получи необходимият закръгляване. Всички изчисления са извършени с помощта логаритми, пет числа или четири числа. Изчисленото количество на веществото претегли само на аналитична везна.
Тежест се извършва или от стъкло за наблюдение, или в тегловно стъкло. Излива се претегля материал се промива в чиста мерителна колба чрез чиста, суха фуния на малки порции. След това, от промиване няколко пъти с малки порции вода промиват през фуния bnzhe или час стъкло, които се претеглят. Фуния и се промива с дестилирана вода от промиване няколко пъти.
За успиване твърди кристали или прахове в мерителна колба много удобен за използване фунията е показано на фиг. 349. Такова фуния произведени опаковката 3, 6 и 10 cm3. Може да бъде директно претеглена проба от тези фунии (не-абсорбиращ материал), предварително определяне на тяхната маса. Връзка на фунията е много лесно се превръща в мерителна колба. Когато претегля излее, фуния без отстраняване от вратовете на колбата се и се промива с дестилирана вода от бутилка за промиване.
Обикновено, при получаването на разтвори и точен превод на разтвореното вещество в мерителна колба разтворител (например, вода) следва да не повече от половината от капацитета на колба. Запушена колба се разклаща до пълното му разтваряне на твърдото вещество. След това, полученият разтвор се допълва с вода до марката и се смесват напълно.
Моларните решения. За получаване 1 литър 1 М разтвор на вещество се претегля на аналитична везна и 1 мол се разтваря, както е описано по-горе.
Пример. За получаване 1 литър 1 М разтвор на сребърен нитрат се броят в таблица или молекулно тегло AgNO3, е равна на 169,875. Солта се претеглят и разтварят във вода.
Ако е необходимо да се получи по-разреден разтвор (0,1 или 0,01 М), се претегля, 0.1 или 0.01 мол сол.
Ако е необходимо да се получи 1 литър разтвор на по-малко след това се разтваря съответно в минимално количество сол екран вода съвпадение.
Нормални разтвори се получават по подобен начин, не само otveshivaya 1 мол и един грам еквивалент твърдо вещество.
При смесване или seminormal разтвор децинормален взети съответно 0.5 или 0.1 грам-еквивалент. Когато не получаване на 1 литър разтвор, и по-малко, например 100 или 250 мл, след това berut1 / 10, или 1/4 от количеството вещество, което се изисква за получаване на I л и се разтваря в подходящ обем вода.
Фигура 349. фунии за успиване и колба проба.
След приготвяне на разтвор от него, е необходимо да се провери титруване подходящ разтвор с друго вещество, известно нормалност. Приготвеният разтвор не може да отговори точно нормалността, който е определен. В такива случаи, корекцията понякога се прилага.
Изчисляване в получаването на титрант за аналита са също грам-еквивалент на разтвореното вещество, като се използва формулата:

Пример. Да предположим, че е необходимо да се получи 3 L разтвор на калиев перманганат с титър на желязо 0,0050 грама / мл. Грам-еквивалент KMnO4 е 31.61. и грам-еквивалент Fe 55847.
Изчислена чрез горната формула:
Стандартните разтвори. Стандартни разтвори са били наричани с различни, добре определени концентрации, използвани в колориметрия, например разтвори, съдържащи 1 мл от 0.1, 0.01, 0.001 мг, и така нататък. D. разтвореното вещество.
Освен колориметричен анализ, такива решения са необходими за определяне на рН на нефелометрични определяния и др Понякога стандартни разтвори "се съхраняват в запечатани ампули, но често трябва да ги приготвят непосредствено преди употреба стандартни разтвори се приготвят в обем от не повече от 1 л, и ча прорез .. - по-малко. Само когато голяма консумация на стандартни разтвори могат да се приготвят няколко литра него, и след това при условие, че стандартния разтвор няма да се съхраняват в дългосрочен план.
Количеството вещество (в грамове), необходима за получаване на такива разтвори се изчислява по формулата:

Пример. Трябва да се подготви стандартни разтвори на CuSO4 • 5H2O за колориметрично определяне на мед и 1 мл от първия разтвор трябва да съдържат 1 мг мед, а вторият - 0.1 мг, 0.01 мг от третата, четвъртата - 0001 мг. Първоначално подготви достатъчно количество от първия разтвор, като 100 мл.
В този случай, Mi = 249,68; ASU = 63.54; по този начин, за получаване на 100 мл разтвор, 1 мл от които ще съдържат 1 мг меден (Т = 0,001 г / мл), е необходимо да се вземат
Претеглена проба от солта се прехвърля в мерителна колба и се прибавя 100 мл вода до марката. Други разтвори се приготвят чрез разреждане подходящо приготвени.
Емпиричните решения. Концентрацията на тези решения често са изразени в г / л или г / мл. За получаването на разтвори, използвани емпирични пречиства чрез прекристализация вещества или реагенти часа квалификация. D. A. или х. ч.
Пример. Необходимо е да се получи разтвор на CuSO4 0,5 литра, че съдържа Cu 10 мг / мл. За приготвянето на разтвора, използван CuSO4 5H2O •.
За да се изчисли колко трябва да приемат този electr./solar за получаване на предварително определен обем от разтвора се отчита като Cu трябва да се съдържа в него. Към този обем се умножава с предварително определена концентрация, т. Е.
500 * 10 = 5000 мг, или 5.0000 гр
След това, знаейки, молекулното тегло на солта, се отчита желания номер:
На аналитична везна в тегловно стъкло се претегля точно 19,648 грама на чиста сол, тя се превръща в мерителна колба 0.5 л. Разтварянето се осъществява, както е описано по-горе.