Сол - класификацията, получаването и свойства
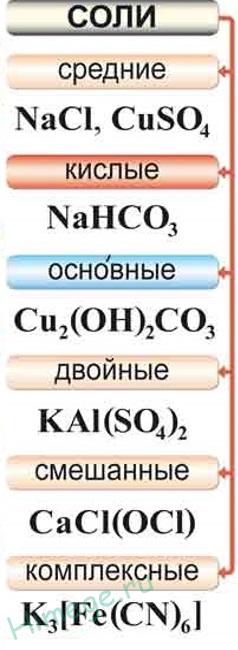
Соли среда наречените продукти на пълно заместване на водородни атома в молекулата, киселинни метални атоми или пълно заместване на бази в остатъци на молекула gidroksogrupp киселина.
Например, Н 3РО 4 - Na3 РО4;
Cu (OH) 2 - CuSO4.
С киселина соли са наречени продукти на непълното заместване на водородни атоми в молекулите на металните атоми на многоосновни киселини.
Например, H 2SO 4 - NaHSO4,
Н 3РО 4 - Na2 НРО 4 - NaH2 РО4.
Основни соли са наречени продукти на непълното заместване gidroksogrupp mnogokislotnyh бази в киселинни остатъци.
Например, Са (ОН) 2 - CaOHCl;
Fe (ОН) 3 - Fe (ОН) 2 Cl - FeOHCl2.
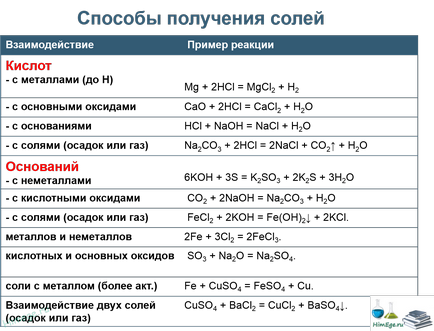
киселина соли реагират с алкални за да образуват соли среда.
КНСО3 + КОН = К 2СО 3 + Н 2О
Някои киселинни соли, например, въглена киселина разлагат под действието на силни киселини:
КНСО3 + HCl = KCl + СО2 + Н 2О
Основни соли реагират с киселина:
Cu (OH) Cl + HCl = CuCl2 + Н 2О
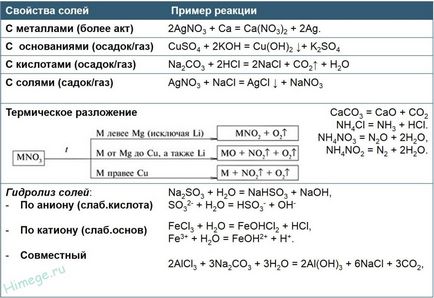
Свойствата на комплексни соли (комплексни соли методи кост)
1) комплексни соли реагират със силни киселини, реакционните продукти зависи от съотношението между реагентите. Под действието на излишък от силна киселина, получена два високо сол и вода. Действието на липсата на силна киселина, получена средна активна метална сол, амфотерен хидроксид и вода, например:
2) При нагряване комплексни соли губят вода:
3) Когато действието на въглероден двуокис, серен диоксид или сероводород получена сол и амфотерен активен метален хидроксид:
4) Когато действието на соли, образувани с катиони Fe 3+. Al 3+ и Cr 3+ взаимно засилване хидролиза получава два амфотерни хидроксид и активна метална сол: