Периодичната таблица на химичните елементи Леу
В природата, има много повтарящи се последователности:
- сезони;
- време на деня;
- дни от седмицата ...
В средата на 19-ти век, Менделеев забелязах, че химичните свойства на елементи също имат определена последователност (да речем идеята дойде при него в съня). Резултатът от прекрасна мечта на учения се превърна в периодичната таблица на химичните елементи, в които DI Менделеев построен химични елементи за увеличаване на атомна маса. В съвременните химична маса елементи са подредени във възходящ атомен номер (брой протони в ядрото на атома).
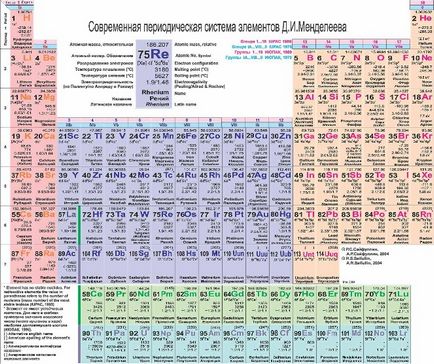
Атомния номер е показано на химически символ, символ - му атомно тегло (сумата от протони и неутрони). Имайте предвид, че атомното тегло на някои елементи не е цяло число! Не забравяйте изотопи! Атомна маса - е средно претеглената стойност на всички изотопи на един елемент се намира естествено в природата.

По-долу в таблицата са разположени лантанидите и актинидите.
хоризонтални периоди линията на периодичната таблица, посочени.
Периодите са номерирани 1-7.
Вертикалните колони от периодичната таблица, посочени групи (семейства).
За номериране групи първоначално приложен римски цифри и букви (IA, IIA, IIIB ...). Сега да се опише групи, като се използва число от 1 до 18 години.
1. Метали и неметали, неметали
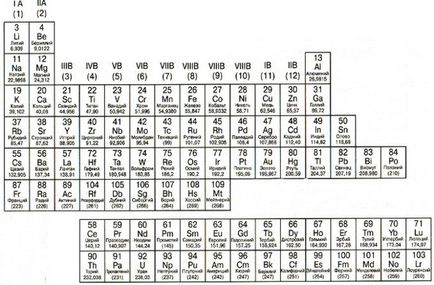
Метали са подредени в периодичната таблица в ляво на пристъпи диагоналната линия, която започва с Бора (B) и завършва полоний (Po) (с изключение на германий (Ge) и антимон (Sb). Това се вижда добре, че метали заемат по-голямата част на периодичната таблица. Основните свойства метали: твърди (с изключение на живак); блясък; добра електрическа и топлинна проводник, пластмасови, ковък, лесно даряват електрони.
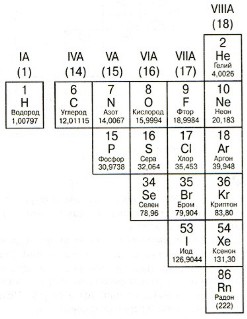
Елементи на правото на диагоналната стъпка Б-РО, наречени неметали. Свойства на неметали са директно противоположни на метални свойства: лоши проводници на топлинна и електрическа енергия; крехка; inductile; не-пластмаса; обикновено приемат електрони.
металоиди
полу-метали (металоиди), разположени между метали и неметали. Те се характеризират със свойства на метали, така и неметали. Основното приложение в индустрията полу-метали, намиращи се в производството на полупроводници, без които не модерен чип или микропроцесор.
2. Периодите и Групи
Както бе споменато по-горе, периодичната таблица е разделена на седем периода. Във всеки период, атомни номера на елементите се увеличи от ляво на дясно.
Свойства на елементи в периоди варират последователно като натрий (Na) и магнезий (Mg), разположен в началото на третия период дари електрони (Na дава един електрон: 1s 2 2s 2 2p 6 3s 1; Mg губи два електрона: 1s 2 2s 2 2p 6 3s 2). Но хлор (Cl), разположен в края на периода, получава един елемент: 1s 2s 2 2 2 2p 6 3s 3P 5.
Свойствата на химичните елементи в рамките на един период са различни.
В групите, а напротив, всички елементи имат същите свойства. Например, в групата IA (1) всички елементи от литий (Li) и завършва Франций (Fr), се дава на електрон. И всички елементи от група VII А (17), получаващи един елемент.
Някои групи са толкова важни, че те са получили специални имена. Тези групи са обсъдени по-долу.
3. Алкални метали
Група IA (1). Атомите на елементи от тази група са във външния слой електрон само един електрон, така че лесно да се получи един електрон.
Най-важните алкални метали - натрий (Na) и калий (К), защото те играят важна роля в човешкия живот и са част от солите.
4. алкалоземни метали
Група IIA (2). Атомите на елементи от тази група са във външния слой на електронен два електрона, която също е дадена по време на химични реакции. Най-важният елемент - калций (Са) - основа на костите и зъбите.
5. Халогени
Група VIIA (17). Атомите на елементи от тази група обикновено се получават от един електрон, защото на външната електронен слой е на петте елемента и на "пълния комплект" просто липсва един електрон.
Най-известните членове на тази група: хлор (Cl) - част от соли и белина; Йод (I) - елемент, който играе важна роля в човешкото щитовидната жлеза.
6. инертен (благороден) газ
Група VIII (18). Атомите на елементи от групите имат напълно "жива" външен електронен слой. Поради това, те "не" приемат електрони. И да им даде това, което "не искам". Следователно - елементите на тази група е много "неохота" влиза в химични реакции. Дълго време се е смятало, че те обикновено не реагират (оттук и терминът "инертен", т.е. "неактивен"). Но химик Нийл Бартлет открива, че някои от тези газове, при определени условия, все още може да реагира с други елементи.
- Ne - 1s 2s 2 2 2p 6;
- Аг - 1s 2s 2 2 2 2p 6 3s 3P 6;
- Кр - 1s 2s 2 2 2p 6 3s 3p 2 6 2 4s 3d 4P 10 6
7. разтягане елементи на Група
Това се вижда добре, че в рамките на всяка група от елементи, подобни на всеки друг с техните валентните електрони (електрони и и р-орбитали, разположени на нивото на външната енергия).
В алкален метал - 1 валентност електрон:
В алкалоземни метали - 2 валентните електрони:
В халогени - 7 валентни електрони:
- F - 1s и 02 февруари 02 февруари р 5;
- Cl - 1s 2s 2 2 2p 06 март 2 Март е р 5;
- BR - 1s 2s 2 2 2 2p 6 3s 3P 4-ти юни и 2 стр 3d 10 05 април
В инертни - 8 валентни електрони:
- Ne - 1s S 02 февруари 02 февруари р 6;
- Аг - 1s 2s 2 2 2p 06 Март 02 март е р 6;
- Кр - 1s 2s 2 2 2 2p 6 3s 3P 4-ти юни и 2 стр 3d 10 април 6
Роман номер колона от групата - е броят на валентен електрон във всички елементи на групата.
Нека сега да насочат вниманието си към елементите, подредени в групи от символи Б. Те са разположени в центъра на периодичната таблица, се наричат преходни метали.
Отличителна черта на тези елементи е наличието на електрони в атома, пълнител г-орбитите:
- Sc - 1S 2s 2 2 2 2p 6 3s 3P 6 4s 2 3d 1;
- Ti - 1s 2s 2 2 2 2p 6 3s 3p 6 4s 2 3d 2
Освен основния таблицата са лантаниди и актиниди - така наречените вътрешни преходни метали. В атоми на тези елементи електрони запълване F-орбитали:
- Се - 1S 2s 2 2 2 2p 6 3s 3P 6 4s 2 4P 6 3d 10 4d 10 5s 5р 2 4f 6 5d 1 1 6s 2;
- Th - 1s 2s 2 2 2 2p 6 3s 3P 6 4s 2 4P 6 3d 10 4d 10 5s 5р 2 4f 6 5d 14 10 6S 2 6p 6 6d 2 7s 2