ензимен анализ
Ензимите играят важна роля в биохимичен анализ. В биологични материали, като телесни течности, чрез определяне на каталитичната активност на ензимите могат да бъдат открити в много малки концентрации. Ензимите могат да се използват като реагенти за определяне на концентрациите на метаболити, като например кръвна глюкоза (Схема В). Повечето ензимни анализи, използвани фотометрия.
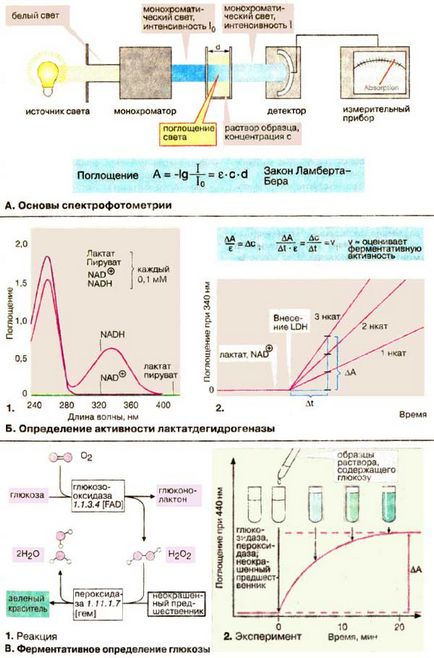
А. Основи на спектрофотометрия
Много молекули абсорбират светлина във видимата или ултравиолетовата област на спектъра. Този имот може да се използва за определяне на концентрацията. Абсорбцията зависи от вида и концентрацията на веществото, както и дължината на вълната на светлина се използва. Ето защо, използвани монохромната светлина. т. е. светлина с определена дължина на вълната, която може да се изолира от бяла светлина с помощта на монохроматор. Монохроматично интензивността на светлината I0 преминава през правоъгълна клетка от стъкло или кварц (кювета), в която абсорбиращ материал е разтвор. интензитет I на възникващите светлина, нарушена абсорбция се измерва с детектор. Поглъщане на светлина (А) на разтвора (оптична плътност) определя като отрицателен логаритъм на съотношение I / I0. Закона Lambert-бира се посочва, че А е пропорционален на концентрацията (ите) на веществото и дебелината (D) на слоя разтвор. коефициент на изчезване # 949; зависи, както е отбелязано по-горе, вида на веществото и дължината на вълната.
Б. Определяне на лактат дехидрогеназа активност
Определяне на лактат дехидрогеназа [LDH (LDH)] основава на факта, че намалява коензим NADH + H + абсорбира светлина при 340 нм, докато NAD + (NAD +) при тази дължина на вълната не е абсорбция. Абсорбционните спектри (т. е. графичен в зависимост от дължината на вълната) на субстрата и коензим в реакционната LDH показано на фиг. B1.
Разликите в усвояването на NAD + и NADH между 300 и 400 нм се дължат на вариации на никотинамид пръстен в окисление или редукция (вж. Стр 102). За да се определи активността в кюветата се поставя предимно разтвори на лактат и NAD + и абсорбцията се отчита при постоянна дължина на вълната 340 нм. Некаталитична реакция протича при много ниска скорост. Следователно, измереното количество NADH образува само след добавянето на LDH. Тъй като скоростта на нарастване на абсорбцията # 916 А / # 916; тон на закона за бира-Lambert е пропорционална на скоростта на реакцията # 916 С / # 916; т. LDH активността може да се изчислява при използване на екстинкционен коефициент # 949; при 340 пМ или чрез сравняване със стандартен разтвор.
Б. Ензимно определяне на глюкоза
Повечето биомолекули не поглъщат светлина във видимата и ултравиолетовата част на спектъра. Освен това, те са обикновено присъства в смес с други съединения, които също дават подобни химични реакции. Двете проблеми могат да бъдат преодолени чрез подходящ ензим за селективно превръщане определя метаболит в оцветен вещество, което по-нататък се определя от интензитета на светлината абсорбция.
Обичайният метод за определяне на глюкоза в кръвта (.. 162 cm) се основава на две последователни реакции:
1) образуване на глюконолактон и водороден пероксид Н 2О 2 с оксидаза ензим глюкоза;
2) окисляване на безцветно вещество на водороден пероксид в зелен цвят съединение в реакция, катализирана от пероксидаза.
Когато цялата налична глюкоза в пробата се използва нагоре, количеството на оцветени вещества, образувани могат да бъдат определени чрез светлинна абсорбция, която е право пропорционална на оригиналното съдържание на глюкоза.